1. ELÄINLÄÄKKEEN NIMI
Itrafungol vet 10 mg/ml oraaliliuos
2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
Yksi ml sisältää:
Vaikuttava aine :
itrakonatsoli 10 mg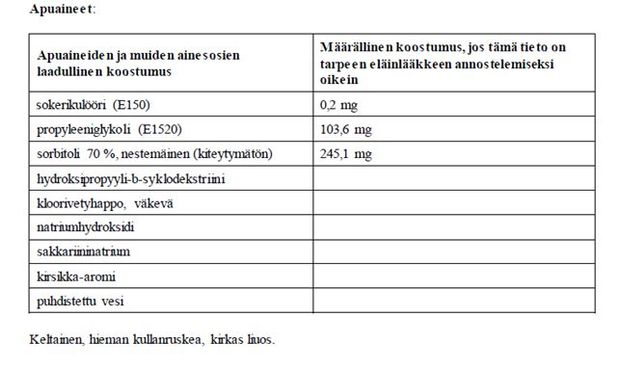
3.1 Kohde-eläinlaji(t)
Kissa.
3.2 Käyttöaiheet kohde-eläinlajeittain
Microsporum canis -sienen aiheuttaman dermatofytoosin hoito.
3.3 Vasta-aiheet
Ei saa käyttää kissoille, jotka ovat yliherkkiä itrakonatsolille tai muille valmisteen sisältämille
aineille.
Ei saa käyttää kissoille, joilla on maksan tai munuaisten toiminnan vajaus.
Käyttö tiineille ja imettäville kissoille: ks. kohta 3.7.
3.4 Erityisvaroitukset
Kissan dermatofytoosi saattaa joskus olla vaikeasti parannettava sairaus erityisesti
kissakenneleissä. Itrakonatsoli-lääkityksellä olevat kissat voivat edelleen levittää M. canis
-tartuntaa, mikäli ne eivät ole vielä sieniviljelyn perusteella täysin parantuneita. Tartunnan
leviämisen estämiseksi ja uuden tartunnan välttämiseksi tulisi terveet eläimet (koirat mukaan
lukien, koska myös ne voivat saada tartunnan) pitää erillään hoidettavista eläimistä hoidon aikana.
Eläinten elinympäristön puhdistaminen ja desinfiointi siihen tarkoitukseen soveltuvilla
valmisteilla on erittäin suositeltavaa varsinkin, jos ihon sienitulehdusta esiintyy useammalla
eläimellä.
Eläinlääkäriin tulee ottaa yhteyttä ennen tartunnan saaneen kissan karvojen leikkausta.
Kissan karvojen leikkausta pidetään hyödyllisenä, koska näin poistetaan infektoituneet karvat,
edistetään uusien karvojen kasvua ja nopeutetaan paranemista. Karvapeitteen leikkausta suositellaan
eläinlääkärin tehtäväksi. Vaurioituneen ihoalueen ollessa pieni, karvapeite voidaan leikata vain
kyseiseltä alueelta. Tapauksissa, joissa tulehdus on levinnyt laajalle ihoalueelle, on
suositeltavaa leikata kissan koko karvapeite. Turkkia leikattaessa tulee varoa vahingoittamasta
kissan ihoa.
Toimenpiteen aikana on suositeltavaa käyttää suojavaatetusta sekä kertakäyttöisiä suojakäsineitä.
Karvojen leikkaus tulee suorittaa hyvin tuuletetussa tilassa, joka voidaan desinfioida toimenpiteen
jälkeen. Karvat tulee hävittää tarkoituksenmukaisella tavalla. Lisäksi kaikki toimenpiteeseen
käytetyt välineet mm. karvaleikkurit, tulee desinfioida.
Dermatofytoosin hoidoksi ei riitä pelkkä sairastuneiden eläinten lääkitys. M. canis -sienen itiöt
voivat elää eläinten ympäristössä jopa 18 kuukautta, joten myös eläinten elinympäristö tulee
desinfioida siihen sopivalla, sieniä tappavalla valmisteella. Tartunnan uusiutumista tai leviämistä
voidaan ennaltaehkäistä imuroimalla usein sairaan eläimen elinympäristöä, desinfioimalla
turkinhoitovälineet ja hävittämällä kissan ympäristöstä mahdollisesti kontaminoituneet tarvikkeet,
joita ei voida desinfioida. Desinfiointia ja imurointia tulee jatkaa riittävän pitkään vielä kissan
kliinisten oireiden parannuttua, mutta imurointi tulee rajoittaa vain pinnoille, joita ei voida
puhdistaa pyyhkimällä kostealla liinalla. Kaikki muut pinnat tulee puhdistaa pyyhkimällä kostealla
liinalla. Kaikki siivoukseen käytetyt liinat tulee pestä ja desinfioida tai hävittää, imurin
pölypussi tulee hävittää asianmukaisesti.
M. canis -sienen tarttumista toisiin kissaryhmiin voidaan ehkäistä eristämällä uudet kissat sekä
näyttelyistä tai siitoskäytöstä palaavat kissat, estämällä vierailijoiden pääsy kissojen luo sekä
tutkimalla eläimet säännöllisesti M. canis -sieni-infektion varalta joko UV-valon (Woodin lamppu)
tai sieniviljelyn avulla.
Huonosti paranevissa tapauksissa mahdollisesti taustalla oleva muu sairaus tulee selvittää.
Säännöllinen ja toistuva antimykoottien käyttö voi johtaa resistenssin kehittymiseen samaan
luokkaan kuuluville antimykooteille.
Katso kohta 3.5 Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on
noudatettava.
3.5 Käyttöön liittyvät erityiset varotoimet
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Dermatofytoosia sairastavia kissoja, joilla on huono yleiskunto ja/tai muu samanaikainen sairaus
tai jotka kärsivät heikentyneestä immuunivasteesta, tulee seurata tarkasti hoidon aikana. Nämä eläimet voivat olla heikon yleistilansa vuoksi muita herkempiä saamaan haittavaikutuksia. Jos hoidettavalla kissalla ilmenee vakava haittavaikutus, tulee lääkitys keskeyttää ja tarvittaessa eläimelle tulee antaa tukihoitoa (nestehoito). Hoito tulee keskeyttää välittömästi, mikäli kliinisiä merkkejä maksan vajaatoiminnan kehittymisestä esiintyy. Maksaentsyymien tarkkailu on erittäin tärkeää, mikäli eläimellä ilmenee merkkejä maksan vajaatoiminnasta.
Ihmisillä itrakonatsolin käyttöön on liittynyt sydämen vajaatoimintaa johtuen aineen negatiivisesta
inotrooppisesta vaikutuksesta. Kissoja, jotka kärsivät sydämen vajaatoiminnasta tulee seurata
huolellisesti hoidon aikana ja mikäli sydänsairauden oireet pahenevat, tulee hoito keskeyttää.
Valmisteen käytön tulee perustua kohdepatogeeni(e)n tunnistamiseen ja herkkyystestaukseen. Jos tämä
ei ole mahdollista, hoidon tulee perustua epidemiologiseen tietoon ja kohdepatogeenien
paikallista/alueellista herkkyyttä koskeviin tietoihin.
Valmisteen käytössä tulee noudattaa mikrobilääkkeitä koskevia virallisia, kansallisia ja
alueellisia ohjeita.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Mikäli ihmisellä esiintyy epätavallisia ihomuutoksia, tulee ottaa yhteyttä lääkäriin, koska M.
canis on zoonoosi. Lateksikäsineitä tulee käyttää kissan karvoja ajeltaessa, käsiteltäessä eläintä
hoidon aikana ja pestäessä mittaruiskua.
Kissaa hoitavan henkilön tulee pestä kätensä ja lääkkeelle altistuneet ihoalueensa valmisteen
käsittelyn jälkeen. Jos valmistetta joutuu silmiin, niin huuhtele silmiä huolellisesti vedellä.
Mikäli kipua tai ärsytystä aiheutuu, käänny välittömästi lääkärin puoleen ja näytä hänelle
pakkausseloste tai myyntipäällys. Jos valmistetta joutuu vahingossa suuhun, huuhtele suu vedellä.
Erityiset varotoimet, jotka liittyvät ympäristön suojeluun:
Ei oleellinen.
3.6 Haittatapahtumat
Kliinisissä kokeissa on todettu joitakin haittavaikutuksia, jotka voivat olla yhteydessä valmisteen
käyttöön.
Yleinen
(1–10 eläintä 100 hoidetusta eläimestä):
Hyvin harvinainen
(< 1 eläin 10 000 hoidetusta eläimestä, yksittäiset ilmoitukset mukaan luettuina):
Oksentelu, ripuli, ruokahaluttomuus, lisääntynyt syljeneritys, alakuloisuus ja apaattisuus. *
Maksaentsyymien ohimenevä nousu (hyvin harvinaisissa tapauksissa tähän on liittynyt ikterusta). **
* Nämä haittavaikutukset ovat yleensä lieviä ja ohimeneviä.
** Mikäli kliinisiä merkkejä maksan vajaatoiminnasta esiintyy, tulee hoito keskeyttää välittömästi.
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeiden turvallisuuden
jatkuvan seurannan. Ilmoitukset lähetetään mieluiten eläinlääkärin kautta joko myyntiluvan
haltijalle tai sen paikalliselle edustajalle tai kansalliselle toimivaltaiselle viranomaiselle
kansallisen
ilmoitusjärjestelmän kautta. Lisätietoja yhteystiedoista on myös pakkausselosteen kohdassa 16.
3.7 Käyttö tiineyden, laktaation tai muninnan aikana
Tiineys ja laktaatio:
Ei saa käyttää tiineille tai imettäville kissoille. Laboratorioeläimillä tehdyissä
yliannostustutkimuksissa on havaittu sikiöiden epämuodostumia ja resorptiota.
3.8 Yhteisvaikutukset muiden lääkkeiden kanssa ja muunlaiset yhteisvaikutukset
Itrafungolin ja kefovesiinin yhteiskäytön yhteydessä on esiintynyt oksentelua sekä maksan ja
munuaisten toimintahäiriöitä. Oireita, kuten motoriikan häiriöitä, ummetusta ja dehydraatiota on
havaittu annettaessa samanaikaisesti tolfenaamihappoa ja Itrafungolia. Kissoihin kohdistuvan
tutkimustiedon puutteen vuoksi valmisteen ja mainittujen lääkkeiden yhteiskäyttöä tulee välttää.
Käytettäessä itrakonatsolia ihmisillä yhteisvaikutuksia tiettyjen muiden lääkeaineiden kanssa on
havaittu johtuen sytokromi P450 3A4 (CYP3A4) ja P-glykoproteiinien (PgP) yhteisvaikutuksista. Tämä
voi johtaa esim. oraalisen midatsolaamin, syklosporiinien, digoksiinin, kloramfenikolin,
ivermektiinin tai metyyliprednisolonin plasman lääkeainepitoisuuksien nousuun. Plasmapitoisuuden
nousu voi pidentää lääkeaineen vaikutusaikaa sekä lisätä haittavaikutusten riskiä. Itrakonatsoli
voi myös lisätä suun kautta annettavien diabeteslääkkeiden pitoisuutta seerumissa, joka voi
puolestaan johtaa potilaan hypoglykemiaan.
Toisaalta tietyt lääkeaineet, esim. barbituraatit ja fenytoiini, voivat nopeuttaa itrakonatsolin
metaboliaa alentaen hyväksikäytettävyyttä ja siten heikentää itrakonatsolin tehoa. Antasidien
samanaikainen käyttö vähentää merkittävästi itrakonatsolin imeytymistä, sillä lääkeaine imeytyy
parhaiten happamassa ympäristössä. Erytromysiinin yhtäaikainen käyttö voi lisätä plasman
itrakonatsolipitoisuutta.
Ihmisillä yhteisvaikutuksia on havaittu myös itrakonatsolin ja kalsium-antagonistien välillä. Nämä
lääkkeet saattavat lisätä sydämeen kohdistuvia negatiivisia inotrooppisia vaikutuksia.
Edellä mainittujen lääkeaineiden yhteisvaikutusten merkitystä kissoilla ei tunneta. Koska
tarpeellista tietoa ei ole saatavilla, yhteiskäyttöä itrakonatsolin ja edellä mainittujen
lääkeaineiden välillä tulee välttää.
3.9 Antoreitit ja annostus
Suun kautta.
Nestettä annetaan mittaruiskulla suoraan kissan suuhun. Päivittäinen kerta-annos on 5 mg/kg, mikä
vastaa annosta 0,5 ml/kg.
Päiväannos 0,5 ml/kg annetaan kolmessa seitsemän päivän mittaisessa hoitojaksossa. Kunkin
hoitojakson välissä pidetään seitsemän välipäivää, jolloin valmistetta ei anneta.
7 päivää 7 päivää 7 päivää 7 päivää 7 päivää Lääkitys Ei lääkettä Lääkitys
Ei lääkettä Lääkitys
Jokainen mittaruiskuun merkitty viivojen väli vastaa kissan 100 elopainogramman hoitoon tarvittavaa
valmisteen määrää. Mittaruisku täytetään vetämällä ruiskun mäntää ulos kissan elopainoa vastaavan
viivan kohdalle.
Kissanpentuja hoidettaessa tulee kiinnittää erityistä huomiota siihen, ettei pennulle anneta
enempää lääkettä kuin sen painoa vastaava suositeltu annos. Alle 0,5 kg painoisia kissanpentuja
hoidettaessa tulee käyttää 1 ml ruiskua tarkan annoksen varmistamiseksi.
Valmiste ruiskutetaan hitaasti ja hellävaraisesti kissan suuhun siten, että kissa ennättää niellä
nesteen.
Lääkkeen annon jälkeen ruisku tulee poistaa pullosta, pestä ja kuivata. Pullo tulee sulkea
tiiviisti korkilla.
Ihmisillä on todettu, että ruokailu lääkkeen oton yhteydessä heikentää lääkkeen imeytymistä, joten
on suositeltavaa annostella lääke ruokailujen välisenä aikana.
Joissain tapauksissa kliinisen ja mykologiseen näytteenottoon perustuvan paranemisen välillä on
ajallinen ero. Jos sieniviljelytulos on positiivinen 4 viikkoa lääkityksen lopettamisen jälkeen,
tulee lääkitys toistaa kerran saman lääkitysohjelman mukaan. Mikäli hoidettava kissa kärsii
heikentyneestä immuunivasteesta, tulee lääkitys toistaa ja lisäksi taustalla oleva muu sairaus
hoitaa.
3.10 Yliannostuksen oireet (sekä tarvittaessa toimenpiteet hätätilante essa ja vasta-aineet)
Kuuden viikon ajan annetun viisinkertaisen yliannoksen on kuvattu aiheuttaneen korjaantuvia
kliinisiä haittavaikutuksia: turkin karkeutumista, ruokahaluttomuutta ja laihtumista. Kuuden viikon
ajan annettu kolminkertainen yliannos ei aiheuttanut kliinisiä haittavaikutuksia. Kumpikin edellä
mainituista annoksista aiheutti korjaantuvia seerumin biokemiallisten parametrien muutoksia, jotka
viittaavat maksaan kohdistuvaan vaikutukseen (ALAT-, AFOS-, bilirubiini- ja ASAT-arvojen nousu).
Viisinkertainen yliannos aiheutti lievää segmentoituneiden neutrofiilien lisääntymistä ja lievää
lymfosyyttien vähenemistä.
Kissanpennuilla yliannostustutkimuksia ei ole tehty.
3.11 Käyttöä koskevat erityiset rajoitukset ja erityiset käyttöehdot, mukaan lukien
mikrobilääkkeiden ja eläimille tarkoitettujen loislääkkeiden käytön rajoitukset resistenssin
kehittymisriskin rajoittamiseksi
Ei oleellinen.
3.12 Varoajat
Ei oleellinen.
4. FARMAKOLOGISET TIEDOT
4.1 ATCvet-koodi: QJ02AC02
4.2 Farmakodynamiikka
Valmiste sisältää itrakonatsolia, joka on synteettinen, laajakirjoinen triatsolisienilääke. Se
tehoaa dermatofyytteihin (Trichophyton spp., Microsporum spp.), hiivasieniin (Candida spp.,
Malassezia spp.), erilaisiin dimorfisiin sieniin, zykomykeetteihin ja kotelosieniin (esim.
Aspergillus spp.).
Itrakonatsolin vaikutus perustuu kykyyn sitoutua erittäin selektiivisesti sienisolun
sytokromi-P-450- isoentsyymeihin. Tämä estää ergosterolin biosynteesin ja muuttaa sienen
solukalvolla olevien entsyymien toimintaa ja solukalvon läpäisevyyttä. Vaikutus on irreversiibeli
ja johtaa sienisolun rakenteen degeneraatioon.
4.3 Farmakokinetiikka
Koe-eläimille suun kautta annettu itrakonatsoli imeytyy nopeasti. Se sitoutuu voimakkaasti
plasmaproteiineihin (> 99 %) ja jakautuu kudoksiin. Itrakonatsolin metaboliassa syntyy yli 30
erilaista hajoamistuotetta, joista hydroksi-itrakonatsolilla on lähtöaineen kaltainen sienten
kasvua estävä vaikutus. Itrakonatsoli erittyy nopeasti lähinnä ulosteeseen.
Kissalle suun kautta annetulla kerta-annoksella 5 mg/kg saavutetaan plasmassa korkein
itrakonatsolipitoisuus (Tmₐₓ) noin 0,525 mg/l kahden tunnin kuluttua annostelusta. AUC₀₋₂₄ t –arvo
on 5 mg.t/l. Itrakonatsolin puoliintumisaika plasmassa on noin 12 tuntia. Kissalle viikon ajan
päivittäin annettu itrakonatsoliannos 5 mg/kg arviolta kaksinkertaistaa kerta-annoksen jälkeen
todetun plasman maksimipitoisuuden. AUC₀₋₂₄ t -arvo nousee kolminkertaisesti saavuttaen arvon 15
mg.t/l ja puoliintumisaika plasmassa pitenee myös kolminkertaiseksi 36 tuntiin.
Noudatettaessa hoitosuunnitelmaa itrakonatsoli häviää plasmasta lähes kokonaan jokaisen
lääkitystauon aikana. Muista eläinlajeista poiketen kissalla yhden suun kautta annetun 5 mg/kg
annoksen jälkeen plasman hydroksi-itrakonatsolipitoisuus on määritysmenetelmän kvantitointirajan
tuntumassa tai sen alapuolella.
Itrakonatsolipitoisuus kissan turkissa vaihtelee. Hoidon aikana pitoisuus nousee saavuttaen
mediaaniarvon 3,0 µg/g (keskiarvo 5,2 µg/g) kolmannen hoitoviikon lopussa. Turkin
itrakonatsolipitoisuudet laskevat vähitellen mediaaniarvoon 1,5 µg/g (keskiarvo 1,9 µg/g)
14 vuorokautta hoidon lopettamisen jälkeen. Hydroksi-itrakonatsolin pitoisuudet karvassa ovat
merkityksettömiä.
Ihmisillä oraaliliuoksen annostelu paaston jälkeen lisää lääkeaineen hyväksikäytettävyyttä.
5. FARMASEUTTISET TIEDOT
5.1 Merkittävät yhteensopimattomuudet
Ei tunneta.
5.2 Kestoaika
Avaamattoman pakkauksen kestoaika: 2 vuotta.
Sisäpakkauksen ensimmäisen avaamisen jälkeinen kestoaika: 5 viikkoa.
5.3 Säilytystä koskevat erityiset varotoimet
Älä säilytä yli 25 °C.
Pidä pakkaus tiiviisti suljettuna.
5.4 Pakkaustyyppi ja sisäpakkauksen kuvaus
Pahvirasiaan pakattu kullanruskea lasipullo (tyyppi III), joka sisältää 52 ml oraaliliuosta. Pullo
on suljettu lapsiturvallisella polypropeenikierrekorkilla, jossa on LDPE-muovinen ruiskun liitin.
Pakkauksessa on lisäksi mitta-asteikolla varustettu ruisku annostelua varten.
5.5 Erityiset varotoimet käyttämättömien lääkevalmisteiden tai niistä peräisin olevien
jätemateriaalien hävittämiselle
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään lääkkeiden
paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia
kansallisia keräysjärjestelmiä.
6. MYYNTILUVAN HALTIJAN NIMI
VIRBAC
7. MYYNTILUVAN NUMERO(T)
19307
8. ENSIMMÄISEN MYYNTILUVAN MYÖNTÄMISPÄIVÄMÄÄRÄ
Ensimmäisen myyntiluvan myöntämispäivämäärä: 30/06/2004
9. VALMISTEYHTEENVEDON VIIMEISIMMÄN TARKISTUKSEN PÄIVÄMÄÄRÄ
20.02.2023
10. ELÄINLÄÄKKEIDEN LUOKITTELU
Eläinlääkemääräys.
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa
(https://medicines.health.europa.eu/veterinary).
