LIITE I
VALMISTEYHTEENVETO
1. ELÄINLÄÄKKEEN NIMI
Alizin 30 mg/ml injektioneste, liuos koiralle
2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
Yksi ml sisältää:
Vaikuttava aine:
Aglepristoni.................................30 mg
Apuaineet:
Apuaineiden ja muiden ainesosien laadullinen koostumus
Etanoli, vedetön
Maapähkinäöljy, puhdistettu
Kirkas, keltainen, öljymäinen liuos.
3. KLIINISET TIEDOT
3.1 Kohde-eläinlaji(t)
Koira (narttu).
3.2 Käyttöaiheet kohde-eläinlajeittain
Tiineet nartut: abortin induktio enintään 45 päivää parittelun jälkeen.
3.3 Vasta-aiheet
Ei saa käyttää koirille, joiden maksan tai munuaisten toiminta on heikentynyt, diabeettisille eläimille
tai huonokuntoisille koirille.
Ei saa käyttää koirille, joilla on joko manifestoitunut tai latentti hypoadrenokortisismi (Addisonin
tauti) tai koirille, joilla on geneettistä taipumusta hypoadrenokortikismiin.
Ei saa käyttää koirille, joiden tiedetään olevan yliherkkiä aglepristonille tai eläinlääkkeen apuaineelle.
3.4 Erityisvaroitukset
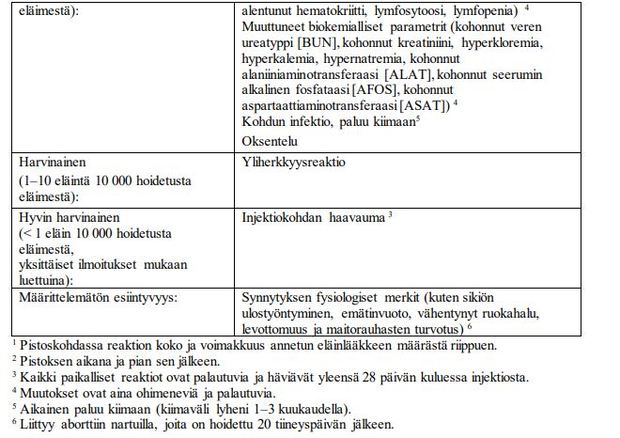
Harvinaisia tehottomuutta (> 0,01 % – < 0,1 %) koskevia tapauksia on raportoitu
lääketurvaseurannassa. Vältä Alizin-valmisteen käyttöä ennen kiiman loppumista ja vältä uutta
parittelua ennen kiiman loppumista, jotta voidaan vähentää odotetun tehon puuttumisen
mahdollisuutta.
Vahvistetusti tiineillä nartuilla havaittiin kenttätutkimuksissa osittainen abortti 5 %:ssa tapauksista.
Perusteellinen kliininen tutkimus on suositeltava sen varmistamiseksi, että kohtu on täysin tyhjentynyt.
Ihannetapauksessa tutkimus tulisi suorittaa ultraäänellä. Tämä tutkimus on tehtävä 10 päivää hoidon
jälkeen ja vähintään 30 päivää parittelun jälkeen.
Osittaisessa abortissa, tai tapauksissa joissa aborttia ei tapahdu lainkaan, uusintahoitoa voidaan
suositella 10 päivää hoidon jälkeen, päivien 30 ja 45 välillä parittelun jälkeen. Leikkausta on myös
harkittava.
3.5 Käyttöön liittyvät erityiset varotoimet
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Koska saatavilla ei ole tietoja, eläinlääkettä on käytettävä varoen koirilla, joilla on krooninen
obstruktiivinen hengitystiesairaus ja/tai sydän- ja verisuonitauti, erityisesti bakteeriperäinen
endokardiitti.
Kuolemantapauksia on raportoitu valmisteyhteenvedon ohjeista poikkeavan käytön jälkeen vakavasti
sairailla nartuilla kohtuinfektioiden yhteydessä. Syy-yhteyttä on vaikea määrittää, mutta se on
epätodennäköinen.
Paritelleista nartuista jopa 50 % ei tule tiineeksi. Tarpeettoman käsittelyn mahdollisuus on otettava
huomioon eläinlääkkeen hyöty-riskisuhdetta arvioitaessa.
Narttuja, jotka ovat edelleen tiineinä hoidosta huolimatta, on seurattava, koska pentujen elinkelpoisuus
voi vaarantua.
Hoidon mahdollisia pitkäaikaisvaikutuksia ei ole tutkittu.
Omistajia on neuvottava ottamaan yhteyttä eläinlääkäriin, jos heidän koirallaan on seuraavia merkkejä
hoidon jälkeen:
- purulentti tai hemorraginen emätinvuoto
- pitkittynyt emätinvuoto, joka kestää yli 3 viikkoa.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Norsteroideja käytetään ihmisillä keskenmenon aikaansaamiseen. Tahaton injektio voi olla erityinen
vaara naisille, jotka ovat raskaana, suunnittelevat raskautta tai joiden raskausstatusta ei tunneta.
Eläinlääkettä käsittelevän eläinlääkärin ja koiraa pitelevän henkilön on noudatettava varovaisuutta,
jotta vältytään vahingossa tapahtuvalta injektiolta. Raskaana olevien naisten tulee antaa eläinlääkettä
varoen. Tämä on öljypohjainen eläinlääke, joka voi aiheuttaa pitkittyneitä paikallisia reaktioita
injektiokohdassa. Jos vahingossa injisoit itseesi valmistetta, käänny välittömästi lääkärin puoleen ja
näytä hänelle pakkausseloste tai myyntipäällys.
Hedelmällisessä iässä olevien naisten tulee välttää kosketusta eläinlääkkeen kanssa tai käyttää
kertakäyttöisiä muovikäsineitä antaessaan eläinlääkettä.
Erityiset varotoimet, jotka liittyvät ympäristön suojeluun:
Ei oleellinen.
3.6 Haittatapahtumat
Koira (narttu).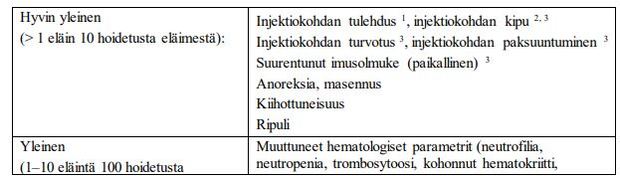
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeiden turvallisuuden jatkuvan
seurannan. Ilmoitukset lähetetään mieluiten eläinlääkärin kautta joko myyntiluvan haltijalle tai sen
paikalliselle edustajalle tai kansalliselle toimivaltaiselle viranomaiselle kansallisen
ilmoitusjärjestelmän kautta. Lisätietoja yhteystiedoista on myös pakkausselosteessa.
3.7 Käyttö tiineyden, laktaation tai muninnan aikana
Tiineys:
Ei saa antaa tiineille nartuille, ellei tiineyden keskeyttäminen ole toivottavaa.
Ei saa antaa nartulle, kun parittelusta on kulunut yli 45 päivää.
3.8 Yhteisvaikutukset muiden lääkkeiden kanssa ja muunlaiset yhteisvaikutukset
Koska saatavilla ei ole tietoja, aglepristonin ja ketokonatsolin, itrakonatsolin ja erytromysiinin
yhteisvaikutuksen riski voi olla olemassa.
Koska aglepristoni on antiglukokortikoidi, se voi vähentää glukokortikoidihoidon vaikutusta.
Mahdollisia yhteisvaikutuksia muiden lääkkeiden kanssa ei ole tutkittu.
3.9 Antoreitit ja annostus
Ihon alle.
Anna 10 mg/kg aglepristonia, joka vastaa 0,33 ml eläinlääkettä painokiloa kohti, kahdesti 24 tunnin
välein.
Nartun paino 3 kg 6 kg 9 kg 12 kg 24 kg 30 kg 42 kg
Eläinlääkkeenmäärä 1 ml 2 ml 3 ml 4 ml 8 ml 10 ml 14 ml
Vaikeita paikallisia reaktioita voidaan välttää, jos eläinlääke annetaan niskaan. Injektiokohdan kevyttä
hierontaa suositellaan.
Suurikokoisille nartuille suositellaan pistämään enintään 5 ml yhteen kohtaan.
Tämä eläinlääke ei sisällä antimikrobista säilöntäainetta. Pyyhi injektiopullon kuminen tulppa ennen
kunkin annoksen ottamista. Käytä kuivaa, steriiliä neulaa ja ruiskua.
Kun eläinlääke on annettu koirille, abortti (tai resorptio) tapahtuu 7 päivän kuluessa.
Tulppa voidaan läpäistä turvallisesti enintään 10 kertaa.
3.10 Yliannostuksen oireet (sekä tarvittaessa toimenpiteet hätätilanteessa ja vasta-aineet)
30 mg/kg eli 3 kertaa suositeltua annosta suurempi annos nartuilla ei aiheuttanut havaittavia
haittavaikutuksia lukuun ottamatta paikallisia tulehdusreaktioita, jotka liittyivät suurempiin
injektiotilavuuksiin.
3.11 Käyttöä koskevat erityiset rajoitukset ja erityiset käyttöehdot, mukaan lukien
mikrobilääkkeiden ja eläimille tarkoitettujen loislääkkeiden käytön rajoitukset resistenssin
kehittymisriskin rajoittamiseksi
Ei oleellinen.
3.12 Varoajat
Ei oleellinen.
4. FARMAKOLOGISET TIEDOT
4.1 ATCvet-koodi: QG03XB90
4.2 Farmakodynamiikka
Aglepristoni on synteettinen steroidi, joka estää progesteronin vaikutusta kilpailemalla tämän
hormonin kanssa kohdun reseptorien tasolla, mikä johtaa tiineyden keskeytymiseen (tai resorptioon)
7 päivän kuluessa lääkityksen jälkeen.
Aglepristoni ei muuta progesteronin, prostaglandiinien, oksitosiinin tai kortisolin pitoisuutta plasmassa
24 tunnin kuluessa sen antamisesta, mutta se aiheuttaa prolaktiinin erittymisen 12 tunnin kuluessa.
In vitro, aglepristonin affiniteetti progesteronireseptoreihin koiran kohdussa on 3 kertaa suurempi kuin
progesteronilla.
Glukokortikoidireseptoreihin kohdistuva aglepristonin suhteellinen sitoutumisaffiniteetti on
samanlainen kuin deksametasonilla, mutta aglepristonilla on antagonistisia ominaisuuksia.
4.3 Farmakokinetiikka
Kun on annettu 2 injektiota 10 mg/kg/vrk 24 tunnin välein, enimmäispitoisuus (noin 280 ng/ml)
saavutetaan 2,5 päivän kuluttua. Keskimääräinen viipymä on noin 6 päivää: tämä jakso sisältää
keskimääräisen absorptioajan pistoskohdasta.
Radioaktiivisuuden erittyminen on hyvin hidasta 10 mg/kg:n radioleimatun annoksen antamisen
jälkeen. Vain 60 % annetusta annoksesta erittyy ensimmäisten 10 päivän aikana ja noin 80 %
24 päivän aikana.
Erittyminen tapahtuu pääasiassa ulosteen kautta (noin 90 %).
5. FARMASEUTTISET TIEDOT
5.1 Merkittävät yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, eläinlääkettä ei saa sekoittaa muiden
eläinlääkkeiden kanssa.
5.2 Kestoaika
Avaamattoman pakkauksen kestoaika: 3 vuotta
Sisäpakkauksen ensimmäisen avaamisen jälkeinen kestoaika: 28 vuorokautta.
5.3 Säilytystä koskevat erityiset varotoimet
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Jos ilmeistä kasvua tai värimuutoksia ilmenee, eläinlääke on hävitettävä.
5.4 Pakkaustyyppi ja sisäpakkauksen kuvaus
Väritön injektiopullo (lasi, tyyppi II) sisältäen 5 ml, 10 ml tai 30 ml, ja joka on suljettu
bromibutyylitulpalla ja alumiinikorkilla.
Pakkauskoot:
- pahvikotelo, jossa on 1 injektiopullo, jossa on 5 ml, 10 ml tai 30 ml
- pahvikotelo, jossa on 10 injektiopulloa, joissa kussakin on 10 ml.
Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
5.5 Erityiset varotoimet käyttämättömien eläinlääkkeiden tai niistä peräisin olevien
jätemateriaalien hävittämiselle
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään lääkkeiden
paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia
keräysjärjestelmiä.
6. MYYNTILUVAN HALTIJAN NIMI
Virbac
7. MYYNTILUVAN NUMERO(T)
18641
8. ENSIMMÄISEN MYYNTILUVAN MYÖNTÄMISPÄIVÄMÄÄRÄ
Ensimmäisen myyntiluvan myöntämispäivämäärä: 11/06/2004
9. VALMISTEYHTEENVEDON VIIMEISIMMÄN TARKISTUKSEN PÄIVÄMÄÄRÄ
17.03.2023
10. ELÄINLÄÄKKEIDEN LUOKITTELU
Eläinlääkemääräys.
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa
(https://medicines.health.europa.eu/veterinary).
