2
1. ELÄINLÄÄKKEEN NIMI
Daxocox 15 mg tabletit koiralle
Daxocox 30 mg tabletit koiralle
Daxocox 45 mg tabletit koiralle
Daxocox 70 mg tabletit koiralle
Daxocox 100 mg tabletit koiralle
Daxocox 140 mg tabletit koiralle
Daxocox 200 mg tabletit koiralle
2. LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
Yksi tabletti sisältää:
Vaikuttava aine:
Enflikoksibi 15 mg
Enflikoksibi 30 mg
Enflikoksibi 45 mg
Enflikoksibi 70 mg
Enflikoksibi 100 mg
Enflikoksibi 140 mg
Enflikoksibi 200 mg
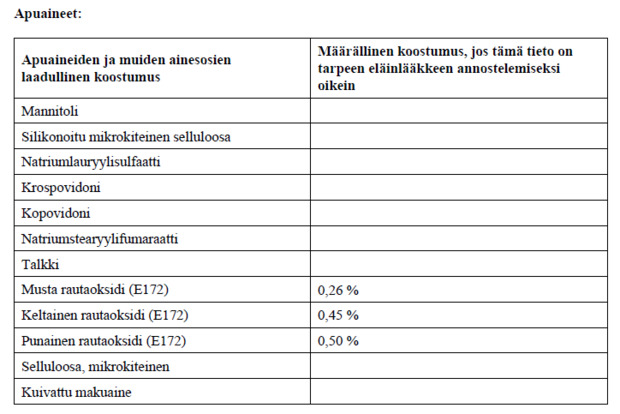
3. KLIINISET TIEDOT
3.1 Kohde-eläinlaji
Koira
3.2 Käyttöaiheet kohde-eläinlajeittain
Nivelrikkoon liittyvän kivun ja tulehduksen hoito.
Ortopediaan ja pehmytkudoskirurgiaan liittyvän kivun ja tulehduksen hoito.
3.3 Vasta-aiheet
Ei saa käyttää eläimille, joilla on ruoansulatuskanavan häiriöitä, proteiinia tai verta menettävä enteropatia tai verenvuotohäiriöitä.
Ei saa käyttää tapauksissa, joissa munuaisten tai maksan toiminta on heikentynyt.
Ei saa käyttää tapauksissa, joissa esiintyy sydämen vajaatoimintaa.
Ei saa käyttää tiineille tai imettäville koirille.
Ei saa käyttää siitoseläimille.
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai apuaineille.
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä sulfonamideille.
Ei saa käyttää nestehukasta, hypovolemiasta tai matalasta verenpaineesta kärsiville eläimille, koska tällöin munuaistoksisuuden riski saattaa kasvaa.
3.4 Erityisvaroitukset
Muita ei-steroidisia tulehduskipulääkkeitä tai glukokortikoideja ei saa antaa samanaikaisesti tämän eläinlääkkeen kanssa tai 2 viikon sisällä tämän eläinlääkkeen viimeisen antokerran jälkeen.
3.5 Käyttöön liittyvät erityiset varotoimet
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Koska eläinlääkkeen turvallisuutta ei ole täysin osoitettu hyvin nuorilla eläimillä, huolellinen tarkkailu on suositeltavaa alle 6 kuukauden ikäisiä koiria hoidettaessa.
Enflikoksibin aktiivinen metaboliitti aiheuttaa puoliintumisajan pitenemistä plasmassa hitaan eliminaationsa vuoksi. Käytä tätä eläinlääkettä eläinlääkärin tarkassa seurannassa, jos on olemassa ruoansulatuskanavan haavaumien riski tai jos eläimellä on aiemmin esiintynyt intoleranssia ei-steroidisille tulehduskipulääkkeille.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Tämä eläinlääke voi aiheuttaa yliherkkyysreaktioita (allergisia reaktioita). Henkilöiden, jotka ovat yliherkkiä ei-steroidisille tulehduskipulääkkeille, tulee välttää kosketusta eläinlääkkeen kanssa.
Jotkut ei-steroidiset tulehduskipulääkkeet saattavat olla haitallisia sikiölle erityisesti kolmannella raskauskolmanneksella. Raskaana olevien naisten tulee käsitellä tätä eläinlääkettä varoen.
Tämän eläinlääkkeen nieleminen voi olla haitallista erityisesti lapsille, ja pitkittyneitä farmakologisia vaikutuksia, jotka johtavat esim. ruoansulatuskanavan häiriöihin, saattaa esiintyä. Jotta valmistetta ei nieltäisi vahingossa, anna tabletti koiralle välittömästi läpipainopakkauksesta ottamisen jälkeen äläkä jaa tai murskaa tabletteja.
Jos vahingossa nielet valmistetta, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Erityiset varotoimet, jotka liittyvät ympäristön suojeluun:
Ei oleellinen.
3.6 Haittatapahtumat
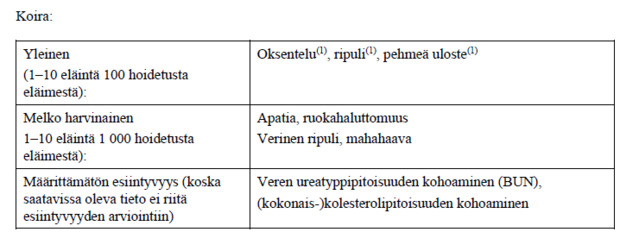
(1) Useimmat tapaukset eivät ole vaatineet hoitoa.
Mikäli haittavaikutuksia esiintyy, eläinlääkkeen käyttö tulee lopettaa ja tulehduskipulääkkeiden yliannostuksessa yleistä tukihoitoa tulee jatkaa niin kauan kunnes oireet ovat hävinneet. Erityistä huomiota tulee kiinnittää hemodynaamisen tilan ylläpitoon.
Eläimille, joilla esiintyy haittavaikutuksia ruoansulatuskanavassa tai munuaisissa, saattaa olla tarpeen antaa sopivia ruoansulatuskanavaa suojaavia valmisteita ja parenteraalista nestehoitoa.
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeiden turvallisuuden jatkuvan seurannan. Ilmoitukset lähetetään mieluiten eläinlääkärin kautta joko myyntiluvan haltijalle tai sen paikalliselle edustajalle tai kansalliselle toimivaltaiselle viranomaiselle kansallisen ilmoitusjärjestelmän kautta. Lisätietoja yhteystiedoista on myös pakkausselosteessa.
3.7 Käyttö tiineyden, laktaation tai muninnan aikana
Eläinlääkkeen turvallisuutta kohde-eläimillä tiineyden, laktaation tai siitoksen aikana ei ole selvitetty.
Tiineys ja laktaatio:
Ei saa käyttää tiineyden tai laktaation aikana.
Laboratoriotutkimuksissa rotilla ja kaneilla on löydetty näyttöä sikiötoksisista vaikutuksista emolle toksisina annoksina.
Hedelmällisyys:
Ei saa käyttää siitoseläimillä.
3.8 Yhteisvaikutukset muiden lääkkeiden kanssa ja muunlaiset yhteisvaikutukset
Tutkimuksia lääkkeiden yhteisvaikutuksista ei ole tehty. Muiden ei-steroidisten tulehduskipulääkkeiden tapaan tätä eläinlääkettä ei saa antaa samanaikaisesti toisten ei-steroidisten tulehduskipulääkkeiden tai glukokortikoidien kanssa.
Eläimiä tulee tarkkailla huolellisesti, jos tätä eläinlääkettä annetaan samanaikaisesti antikoagulantin kanssa.
Enflikoksibi sitoutuu voimakkaasti plasman proteiineihin ja saattaa kilpailla muiden voimakkaasti sitoutuvien aineiden kanssa, jolloin näiden aineiden samanaikaisella käytöllä saattaa olla toksisia vaikutuksia.
Muiden tulehdusta estävien valmisteiden käyttö ennen hoitoa saattaa lisätä tai voimistaa haittavaikutuksia. Tällaisten haittavaikutusten välttämiseksi tulee pitää sopiva lääkkeetön ajanjakso ennen ensimmäisen annoksen antamista, kun tällä eläinlääkkeellä korvataan toinen ei-steroidinen tulehduskipulääke. Lääkkeettömässä ajanjaksossa tulee kuitenkin huomioida aiemmin käytettyjen lääkevalmisteiden farmakologia.
Mahdollisesti nefrotoksisten (munuaisille myrkyllisten) eläinlääkkeiden samanaikaista käyttöä tulee välttää.
3.9 Antoreitit ja annostus
Suun kautta.
Valmistetta annetaan KERRAN VIIKOSSA.
Nivelrikko:
Ensimmäinen annos: 8 mg enflikoksibia painokiloa kohti.
Ylläpitoannos: toista hoito 7 päivän välein 4 mg:n annoksella enflikoksibia painokiloa kohti.

Perioperatiivinen käyttö:
Kerta-annos 8 mg painokiloa kohti on annettava vuorokautta (vähintään 24 tuntia) ennen suunniteltua leikkausta. Jos hoitava eläinlääkäri toteaa 7 päivän kuluttua ensimmäisestä hoidosta (6 päivää leikkauksen jälkeen), että leikkauksen jälkeinen kipulääkitys on tarpeen, seuraavia hoitoja voidaan antaa annoksella 4 mg painokiloa kohti 7 päivän välein.
Eläinlääke tulee antaa välittömästi ennen koiran ateriaa tai sen yhteydessä.
Oikean annostuksen varmistamiseksi eläimen paino on määritettävä mahdollisimman tarkasti.
3.10 Yliannostuksen oireet (sekä tarvittaessa toimenpiteet hätätilanteessa ja vasta-aineet)
Yliannostuksia koskevissa turvallisuustutkimuksissa, joissa valmistetta annettiin viikoittain 12 mg/painokilo 7 kuukauden ajan ja 20 mg/painokilo 3 kuukauden ajan aloitusannoksen jälkeen, havaittiin näyttöä veren ureapitoisuuden ja seerumin kolesterolipitoisuuden kohoamisesta. Muita hoitoon liittyviä vaikutuksia ei havaittu.
3.11 Käyttöä koskevat erityiset rajoitukset ja erityiset käyttöehdot, mukaan lukien mikrobilääkkeiden ja eläimille tarkoitettujen loislääkkeiden käytön rajoitukset resistenssin kehittymisriskin rajoittamiseksi
Ei oleellinen.
3.12 Varoajat
Ei oleellinen.
4. FARMAKOLOGISET TIEDOT
4.1 ATCvet-koodi: QM01AH95
4.2 Farmakodynamiikka
Enflikoksibi on ei-steroidinen tulehduskipulääke, joka kuuluu koksibien ryhmään ja vaikuttaa inhiboimalla selektiivisesti syklo-oksigenaasientsyymi 2:ta (COX-2). Syklo-oksigenaasientsyymi (COX) esiintyy kahtena isoformina. COX-1 on yleensä konstitutiivinen entsyymi, jota ilmennetään kudoksissa, jotka syntetisoivat normaaleista fysiologisista toiminnoista (esim. ruoansulatuskanavassa ja munuaisissa) vastaavia tuotteita. COX-2 on pääasiassa indusoituva ja syntetisoituu makrofagien ja muiden tulehdussolujen toimesta sytokiineillä ja muilla tulehduksen välittäjäaineilla stimuloinnin jälkeen. COX-2 osallistuu kipua, eksudaatiota, tulehdusta ja kuumetta indusoivien välittäjäaineiden, kuten PGE2:n, tuotantoon.
4.3 Farmakokinetiikka
Enflikoksibi imeytyy hyvin suun kautta otettuna; hyötyosuus on korkea ja kasvaa 40–50 % ruoan kanssa. Suositeltu annos perustuu valmisteen antamiseen ruoan kanssa. Kun valmistetta on annosteltu ruokitulle koiralle suun kautta suositellulla aloitusannoksella 8 mg/painokilo, enflikoksibi imeytyy helposti ja saavuttaa maksimipitoisuutensa 1,8 (± 0,4) mikrog/ml (Cmax) 2 tunnin kuluessa (Tmax). Eliminaation puoliintumisaika (t1/2) on 20 tuntia.
Enflikoksibi muuttuu laajalti maksan mikrosomaalisen järjestelmän vaikutuksesta aktiiviseksi pyratsolimetaboliitiksi, joka saavuttaa maksimipitoisuutensa 1,3 (± 0,2) mcg/ml (Cmax) 6 päivän kuluessa (Tmax). Eliminaation puoliintumisaika (t1/2) on 17 päivää.
Enflikoksibi ja sen aktiivinen metaboliitti sitoutuvat voimakkaasti koiran plasman proteiineihin (98–99 %) ja erittyvät pääasiassa ulosteeseen sapen kautta ja vähemmässä määrin virtsaan.
Toistuvien antokertojen jälkeen systeeminen altistuminen enflikoksibille ja sen pyratsolimetaboliitille tasaantuu nopeasti ilman merkkejä aikariippuvaisesta farmakokinetiikasta tai liikakertymisestä kummankaan yhdisteen osalta.
5. FARMASEUTTISET TIEDOT
5.1 Merkittävät yhteensopimattomuudet
Ei oleellinen.
5.2 Kestoaika
Avaamattoman pakkauksen kestoaika: 5 vuotta.
5.3 Säilytystä koskevat erityiset varotoimet
Tämä eläinlääke ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Pidä läpipainopakkaukset ulkopakkauksessa. Herkkä valolle.
Säilytä tabletteja eläinten ulottumattomissa, jotta eläimet eivät niele niitä vahingossa.
5.4 Pakkaustyyppi ja sisäpakkauksen kuvaus
Läpipainopakkaus koostuu PVC/alumiini/orientoitu polyamidi -kalvosta ja alumiinifoliosta.
Pakkauskoot:
Pahvikotelot, joissa 4, 5, 10, 12, 20, 24, 50 tai 100 tablettia Daxocox 15, 30, 45, 70 ja 100 mg pakkauksissa.
Pahvikotelot, joissa 4, 5, 12 tai 20 tablettia Daxocox 140 ja 200 mg pakkauksissa.
Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
5.5 Erityiset varotoimet käyttämättömien eläinlääkkeiden tai niistä peräisin olevien jätemateriaalien hävittämiselle
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään lääkkeiden paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia keräysjärjestelmiä.
6. MYYNTILUVAN HALTIJAN NIMI
Ecuphar NV
7. MYYNTILUVAN NUMERO(T)
EU/2/21/270/001-048
8. ENSIMMÄISEN MYYNTILUVAN MYÖNTÄMISPÄIVÄMÄÄRÄ
Ensimmäisen myyntiluvan myöntämispäivämäärä: 20/04/2021.
9. VALMISTEYHTEENVEDON VIIMEISIMMÄN TARKISTUKSEN PÄIVÄMÄÄRÄ
{KK/VVVV}
10. ELÄINLÄÄKKEIDEN LUOKITTELU
Eläinlääkemääräys.
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa (https://medicines.health.europa.eu/veterinary).
